Презентация - Хлор
просмотров
Текст этой презентации
Слайд 1

Хлор
Презентация по химии
Ученицы 11 класса
Каримовой Юлии
Учитель химии
Столяренко С.Ю.
Слайд 2

Положение в таблице Строение атома Физические свойства История открытия Минералы Получение Химические свойства Применение
Слайд 3

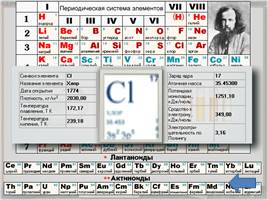
Положение в таблице
Хлор - химический элемент седьмой группы, главной подгруппы, третьего периода периодической системы элементов Д. И. Менделеева, порядковый номер 17, относительная атомная масса 35,4527, относится к галогенам. Общее название элементов VIIA группы – галогены – происходит от греческих слов – "галс" – соль и "генес" – рождающий, т. е. "солероды". У галогенов наиболее ярко по сравнению с остальными элементами выражены свойства неметаллов. Говорят, галогены – типичные неметаллы.
Слайд 4
Слайд 5

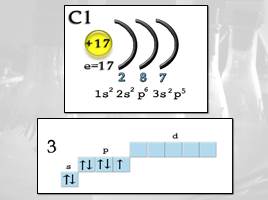
Строение атома
Заряд ядра +17, электронная конфигурация внешней электронной оболочки атома: 3s23p5. Хлор проявляет степени окисления –1, +1, +3, +5, +7 (+4, +6 – редко).
При движении по группе сверху вниз число энергетических уровней увеличивается, значит увеличивается
радиус атома и ослабляется связь валентных электронов с ядром. Таким образом, среди галогенов самый маленький атом у фтора и самый большой у астата. Легче всего оторвать электрон от атома At и труднее – от атома F.
Слайд 6
Слайд 7
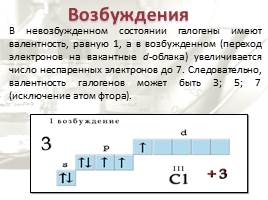
Возбуждения
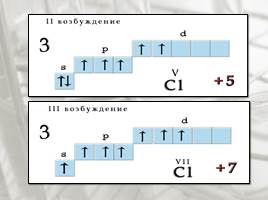
В невозбужденном состоянии галогены имеют валентность, равную 1, а в возбужденном (переход электронов на вакантные d-облака) увеличивается число неспаренных электронов до 7. Следовательно, валентность галогенов может быть 3; 5; 7 (исключение атом фтора).
Слайд 8
Слайд 9
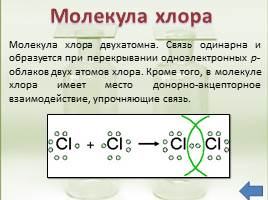
Молекула хлора двухатомна. Связь одинарна и образуется при перекрывании одноэлектронных р-облаков двух атомов хлора. Кроме того, в молекуле хлора имеет место донорно-акцепторное взаимодействие, упрочняющие связь.
Молекула хлора
Слайд 10

Физические свойства
С возрастанием молекулярной массы температуры плавления и кипения веществ, состоящих из молекул одинакового строения, повышаются.
Все галогены окрашены: фтор – светло-желтый, хлор – желтовато-зеленый, бром – красно-коричневый, йод – серо-фиолетовый.
За исключением фтора, который бурно реагирует с водой, галогены мало растворимы в воде. Чтобы приготовить концентрированный раствор, используют другие растворители. Водные растворы галогенов называются соответственно хлорной, бромной и йодной водой, в них галогены сохраняют в значительной мере свои свойства.
Слайд 11

Физические свойства
Хлор – ядовитый газ желто-зеленого цвета с резким запахом. Это первое химическое оружие. Во время Первой мировой войны 1914–1918 гг. его применяли в качестве боевого отравляющего вещества. Хлор тяжелее воздуха в
2,5 раза, поэтому стелется по земле и в виде газового облака переносится ветром на значительные расстояния. Хлор вызывает раздражение дыхательных путей, а вдыхание большого его количества вызывает смерть от удушья. При содержании хлора в воздухе 0,9 мл/л смерть наступает в течение 5 минут.
Слайд 12

Физические свойства
Слайд 13

История открытия
Первым из галогенов был открыт хлор (К. Шееле, 1774 год). Полученный желто-зеленый газ шведский ученый принял за сложное вещество. Лавуазье и Бертолле считали, что этот газ является оксидом неизвестного элемента "мурия".
В 1807 году английский химик Гемфри Дэви получил тот же газ, что и Шееле. Три года пытался Дэви выделить из него "мурий", но безуспешно. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" – желто-зеленый). Через пять лет Гей-Люсак дал газу название хлор. В жидком виде хлор был впервые получен в 1823 году М. Фарадеем.
Слайд 14

В природе встречается два стабильных изотопа хлора:35Cl (75,77%) и 37Cl (24,23%).
Содержание хлора в земной коре составляет 1,7% (по массе). Важнейшие минералы: галит NaCl, сильвин KCl, бишофит MgCl2·H2O, сильвинит KCl·NaCl, карналлит KCl·MgCl2·6H2O. Кроме того, он содержится в виде соединений в морской, речной, озерной водах. Важнейший биоэлемент, необходим для нормальной жизнедеятельности организма. В живом организме содержится 0,15 % от массы тела, входит в состав клеточной и других биологических жидкостей (желудочный сок, плазма).
Распространение в природе
Слайд 15

Минералы
Каменная соль = поваренная соль = галит
Карналлит
Сильвин
Слайд 16

Получение
Основной промышленный способ получения хлора – электролиз хлоридов щелочных металлов (NaCl, KCl). Также его получают окислением HCl кислородом воздуха в присутствии катализаторов – хлорида меди (II) и хлорида железа (III):
4HCl + O2 = 2Cl2 + 2H2O
В лаборатории молекулярный хлор получают взаимодействием HCl с перманганатом калия, оксидом марганца (IV), бихроматом калия и др.: 2KMnO4+16HCl (конц.) = 2KCl+2MnCl2+8H2O+5Cl2
При нагревании: MnO2 + 4 HCl = MnCl2 + Cl2 + 2 H2O
6HCl + KClO3 = 3Cl2 + KCl + 3H2O
Слайд 17

Получение
2KMnO4+16HCl (конц.)= 2KCl + 2MnCl2 + 8H2O + 5Cl2
Слайд 18

Химические свойства
Хлор – активный окислитель. Энергично реагирует с металлами и большинством неметаллов (за исключением O2, N2 и благородных газов). Вступает также в реакции диспропорционирования, для протекания которых наиболее благоприятна щелочная среда, способствующая образованию простых и сложных анионов.
Слайд 19

Хлор - один из самых активных неметаллов. При взаимодействии с металлами с переменной валентностью (Fe, Cr) в отличие от соляной кислоты заставляет их проявлять большую степень окисления:
С Металлами
2Al + 3Cl2 = 2AlCl3
2K + Cl2 = 2 КCl
2 Fe + 3Cl2 = 2 FeCl3
Cu + Cl2 = CuCl2
Слайд 20

Cu+Cl2=CuCl2
2Fe+3Cl2 = 2FeCl3
Слайд 21

H2 + Cl2 = 2 HCl(на свету)
С Неметаллами
2Cl2 + C = CCl4
3Cl2 + 2P (крист.) = 2PCl3
5 Cl2 + 2 P = 2PCl5
Слайд 22

Образует соединения с другими галогенами:
Cl2 + F2 = 2ClF
Cl2 + 3F2 = 2ClF3, t = 200–400 °C
Cl2 + 5F2 = 2ClF5
5Cl2 + 2Sb = 2SbCl5
Слайд 23

Хлор растворяется вводе (в 1 объеме воды растворяется 2 объема хлора) с образованием "хлорной воды": Cl2 + H2O = HCl + HClO
С Водой
Со щелочами
Cl2 + 2KOH(хол) = KCl + KClO(гипохлорит) + H2O
Cl2 + 6KOH(гор) = 5KCl + KClO3(хлорат) + 3H2O
Слайд 24

С Бескислородными Кислотами
Cl2 + HBr = 2HCl + Br2
Cl2 + HI = 2HCl + I2
Cl2 + 2NaI = 2NaCl + I2
Cl2 + FeCl2 = 2FeCl3
С Солями
Слайд 25

Хлор в органике
Хлор является активным реагентом в органическом синтезе. Его атомы входят в состав молекул соединений, относящихся к различным классам органических веществ.
CnH2n+2 + Cl2 (на свету) = CnH2n+1Cl + HCl [р. Семенова]
CnH2n + Cl2 = CnH2nCl2
CnH2n-2 + Cl2 – в несколько стадий
C6H6 + Cl2 (AlCl3) = C6H5Cl + HCl
C6H6 + Cl2 (на свету) = гексахлоран
Гомологи бензола + Cl2 (на свету) = замещение по радикальному механизму (Cl к альфа-H)
5. R-CH2-COOH + Cl2 (PCl5) = R-CHCl-COOH + HCl
Слайд 26

Применение хлора
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: Основным компонентом отбеливателей является хлорная вода В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы.
Слайд 27

Для обеззараживания воды — «хлорирования».
В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.
Слайд 28

Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений. На получение средств защиты растений расходуется значительная часть производимого хлора.
Использовался как оружие массового поражения и в производстве других отравляющих веществ массового поражения: иприт, фосген.
Похожие презентации
 Влияние хлора и соляной кислоты на организм человека
Влияние хлора и соляной кислоты на организм человека
 Углерод и его соединения
Углерод и его соединения
 Эффективные и нетрудоемкие способы регенерации серебра из отходов
Эффективные и нетрудоемкие способы регенерации серебра из отходов
 Цинк
Цинк
 Оксиды углерода (II) и (IV)
Оксиды углерода (II) и (IV)
Поделиться ссылкой на презентацию через:
Код для вставки видеоплеера презентации на свой сайт:

