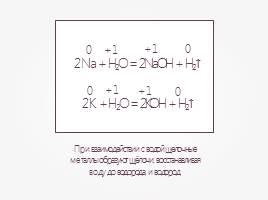Текст этой презентации
Слайд 1

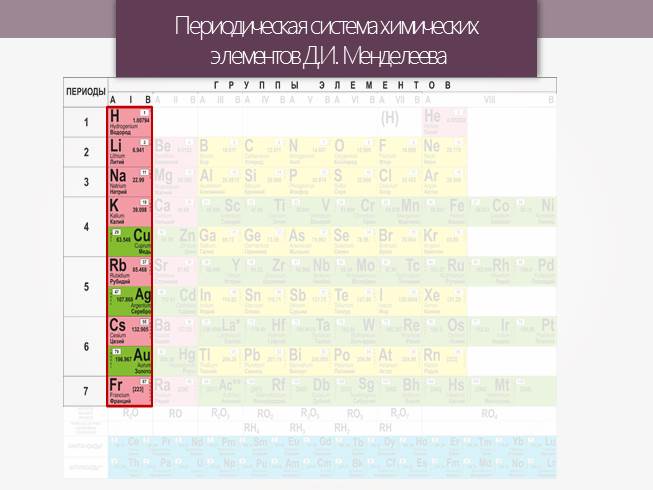
Периодическая система химических элементов Д.И. Менделеева
Слайд 2

А. Арфведсон 1792–1841 гг.
Литий был открыт в 1817 г. шведским химиком А. Арфведсоном. Металл назвали литием, что в переводе с греческого означает «камень».
Слайд 3

Г. Деви 1778–1829 гг.
Впервые литий был получен английским химиком Г. Дэви в 1818 г.
Слайд 4

Г. Деви 1778–1829 гг.
В 1807 г. английский химик и физик Г. Дэви впервые получил натрий в чистом виде при электролизе едкого натра. Он первым изучил его свойства.
Слайд 5
Натрий содержится в организме человека: в эритроцитах крови, сыворотке, пищеварительных соках, играет важную роль в водно-солевом обмене и поддержании кислотно-щелочного равновесия.
Слайд 6

Металлическим натрием восстанавливают из соединений такие ценные металлы, как цирконий, тантал.
Цирконий
Alchemist-hp
Тантал
Слайд 7

Калий
Dnn87
Слайд 8

В природе калий встречается только в соединениях с другими элементами, например, в морской воде, во многих минералах. Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Слайд 9

Калий используют обычно в форме солей. Калийные удобрения — это природные или изменённые в процессе химической обработки соли калия.
Слайд 10

Рубидий
Слайд 11

Цезий
Magnus Manske
Слайд 12

Франций
Маргарита Пере 1909–1975 гг.
Франций был открыт в 1939 г. Маргаритой Пере. Она же дала ему в 1964 г. название в честь своей родины — Франции.
Слайд 13
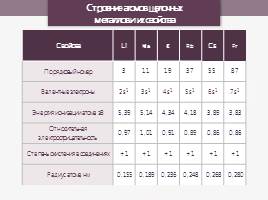
Строение атомов щелочных металлов и их свойства
Свойства Li Na K Rb Cs Fr
Порядковый номер 3 11 19 37 55 87
Валентные электроны 2s1 3s1 4s1 5s1 6s1 7s1
Энергия ионизации атома, эВ 5,39 5,14 4,34 4,18 3,89 3,83
Относительная электроотрицательность 0,97 1,01 0,91 0,89 0,86 0,86
Степень окисления в соединениях +1 +1 +1 +1 +1 +1
Радиус атома, нм 0,155 0,189 0,236 0,248 0,268 0,280
Слайд 14

Металлические свойства
Металлический блеск
Пластичность
Мягкость
Хорошая электропроводность
Хорошая теплопроводность
Слайд 15

Химические свойства металлов
Щелочные металлы активно взаимодействуют почти со всеми неметаллами.
2M + H2 = 2MH
0
0
+1
–1
гидрид
t
Слайд 16

Химические свойства металлов
При взаимодействии щелочных металлов с галогенами образуются соли (галогениды металлов).
2M + Cl2 = 2MCl
0
0
+1
–1
хлорид
t
Слайд 17

Химические свойства металлов
При взаимодействии щелочных металлов с серой образуются сульфиды металлов.
2M + S = M2S
0
0
+1
–2
сульфид
t
Слайд 18

Реакция взаимодействия щелочных металлов с кислородом
4Li + O2 = 2Li2O
0
0
+1
–2
t
Слайд 19
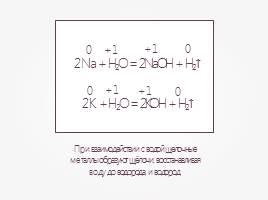
При взаимодействии с водой щелочные металлы образуют щёлочи, восстанавливая воду до водорода, и водород.
2Na + H2O = 2NaOH + H2↑
0
+1
+1
0
2K + H2O = 2KOH + H2↑
0
+1
+1
0
Слайд 20

Соединения щелочных металлов
Галит
Сильвинит
Слайд 21

Оксиды щелочных металлов
Оксиды щелочных металлов являются типичными основными оксидами, они обладают всеми свойствами основных оксидов.
R2O +H2O =2ROH
Слайд 22
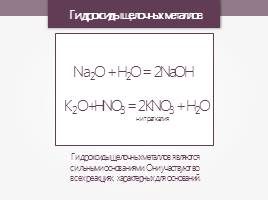
Гидроксиды щелочных металлов
Гидроксиды щелочных металлов являются сильными основаниями. Они участвуют во всех реакциях, характерных для оснований.
Na2O + H2O = 2NaOH
K2O+HNO3 = 2KNO3 + H2O
нитрат калия
Слайд 23

Соли щелочных металлов
Хлорид натрия
Слайд 24
Самая значительная способность калия — поддерживать работу сердечной мышцы, поэтому нехватка калия в организме очень сказывается на здоровье человека. Взрослый человек должен в сутки потреблять с пищей 3,5 г ионов калия.
 Коррозия металлов и способы защиты от коррозии
Коррозия металлов и способы защиты от коррозии
 Химия металлов
Химия металлов
 Углерод и его соединения
Углерод и его соединения
 Художественная обработка металлов и сплавов
Художественная обработка металлов и сплавов
 Чистые вещества и смеси - Способы разделения смесей
Чистые вещества и смеси - Способы разделения смесей