Презентация - Окислительно-восстановительные реакции в органической химии
просмотра
Текст этой презентации
Слайд 1

Окислительно-восстановительные реакции (ОВР) с участием органических веществ
Слайд 2

Горение органических веществ(полное окисление)
Реакция горения приводит к полному окислению органических веществ, в результате чего образуются СО2 и Н2О: 2С4Н10 + 13О2 = 8СО2 + 10Н2О бутан
С2Н4 + 3О2 = 2СО2 + 2Н2О этен
2С2Н2 + 5О2 = 4СО2 + 2Н2О этин
С2Н5ОН + 3О2 = 2СО2 + 3Н2О этанол
При сгорании азотсодержащих веществ выделяется также N2:
4СН3NH2 + 9O2 = 4CO2 + 10H2O + 2N2 метиламин
Горение хлорпроизводных углеводородов сопровождается выделением HСl:
2C2H5Cl + 6O2 = 4CO2 + 4H2O + 2HCl хлорэтан
Слайд 3

Алканы
При обычных условиях устойчивы к действию окислителей (растворы KMnO4, K2Cr2O7). В результате контролируемого каталитического окисления кислородом можно получить спирты, альдегиды, кетоны, карбоновые кислоты:
Слайд 4

Алкены
В зависимости от природы окислителя и условий реакции образуются различные продукты: двухатомные спирты, альдегиды, кетоны, карбоновые кислоты При окислении водным растворoм KMnO4 при комнатной температуре происходит разрыв π-связи и образуются двухатомные спирты (реакция Вагнера): Обесцвечивание раствора перманганата калия - качественная реакция на кратную связь
Слайд 5
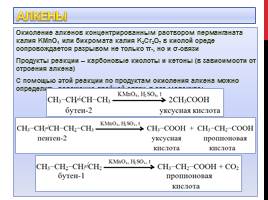
Алкены
Окисление алкенов концентрированным раствором перманганата калия KMnO4 или бихромата калия K2Cr2O7 в кислой среде сопровождается разрывом не только π-, но и σ-связи
Продукты реакции – карбоновые кислоты и кетоны (в зависимости от строения алкена)
С помощью этой реакции по продуктам окисления алкена можно определить положение двойной связи в его молекуле:
Слайд 6

Алкены
Алкены разветвленного строения, содержащие углеводородный радикал у атома углерода, соединенного двойной связью, при окислении образуют смесь карбоновой кислоты и кетона:
Слайд 7

Алкены
Алкены разветвленного строения, содержащие углеводородные радикалы у обоих атомов углерода, соединенных двойной связью, при окислении образуют смесь кетонов:
Слайд 8

Алкены
В результате каталитического окисления алкенов кислородом воздуха получают эпоксиды:
В жестких условиях при сжигании на воздухе алкены, как и другие углеводороды, сгорают с образованием углекислого газа и воды:
С2Н4 + 3О2 → 2СО2 + 2Н2О
Слайд 9

Алкины
Алкины легко окисляются перманганатом калия и бихроматом калия по месту кратной связи
При действии на алкины водным раствором KMnO4 происходит его обесцвечивание (качественная реакция на кратную связь)
При взаимодействии ацетилена с водным раствором перманганата калия образуется соль щавелевой кислоты (оксалат калия):
Слайд 10
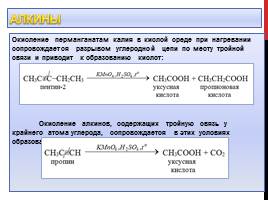
Алкины
Окисление перманганатам калия в кислой среде при нагревании сопровождается разрывом углеродной цепи по месту тройной связи и приводит к образованию кислот: Окисление алкинов, содержащих тройную связь у крайнего атома углерода, сопровождается в этих условиях образованием карбоновой кислоты и СО2:
Слайд 11

Циклоалканы
При действии сильных окислителей (KMnO4, K2Cr2O7 и др.) циклоалканы образуют двухосновные карбоновые кислоты с тем же числом атомов углерода: Адипиновая кислота используется для производства полиамидных волокон – капрона и найлона
Слайд 12

Арены
Бензол Устойчив к окислителям при комнатной температуре
Не реагирует с водными растворами перманганата калия, бихромата калия и других окислителей
Можно окислить озоном с образованием диальдегида:
Слайд 13

Арены
Гомологи бензола
Окисляются относительно легко. Окислению подвергается боковая цепь, у толуола – метильная группа. Мягкие окислители (MnO2) окисляют метильную группу до альдегидной группы:
О //
С6Н5СН3 + MnO2 → C6H5− C Н бензальдегид
Слайд 14
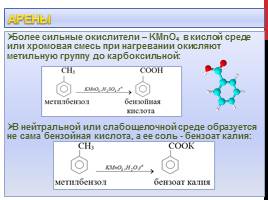
Арены
Более сильные окислители – KMnO4 в кислой среде или хромовая смесь при нагревании окисляют метильную группу до карбоксильной: В нейтральной или слабощелочной среде образуется не сама бензойная кислота, а ее соль - бензоат калия:
Слайд 15
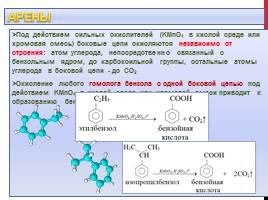
Арены
Под действием сильных окислителей (KMnO4 в кислой среде или хромовая смесь) боковые цепи окисляются независимо от строения: атом углерода, непосредственно связанный с бензольным ядром, до карбоксильной группы, остальные атомы углерода в боковой цепи - до СО2 Окисление любого гомолога бензола с одной боковой цепью под действием KMnO4 в кислой среде или хромовой смеси приводит к образованию бензойной кислоты:
Слайд 16
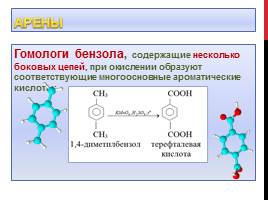
Арены
Гомологи бензола, содержащие несколько боковых цепей, при окислении образуют соответствующие многоосновные ароматические кислоты:
Слайд 17
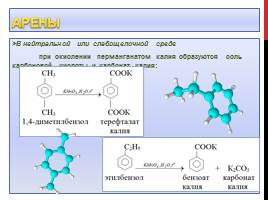
Арены
В нейтральной или слабощелочной среде при окислении перманганатом калия образуются соль карбоновой кислоты и карбонат калия:
Слайд 18
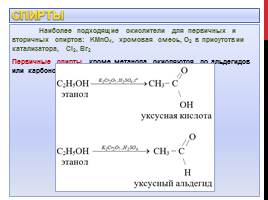
Спирты
Наиболее подходящие окислители для первичных и вторичных спиртов: KMnO4, хромовая смесь, О2 в присутствии катализатора, Cl2, Br2 Первичные спирты, кроме метанола, окисляются до альдегидов или карбоновых кислот:
Слайд 19
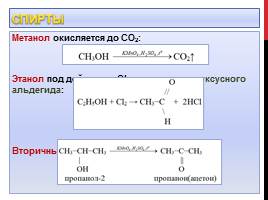
Спирты
Метанол окисляется до СО2: Этанол под действием Cl2 окисляется до уксусного альдегида: Вторичные спирты окисляются до кетонов:
Слайд 20
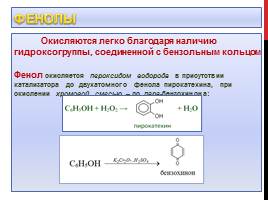
Фенолы
Окисляются легко благодаря наличию гидроксогруппы, соединенной с бензольным кольцом Фенол окисляется пероксидом водорода в присутствии катализатора до двухатомного фенола пирокатехина, при окислении хромовой смесью – до пара-бензохинона:
Слайд 21

Альдегиды и кетоны
Альдегиды окисляются легко, при этом альдегидная группа окисляется до карбоксильной: Метаналь окисляется до CО2:
Слайд 22
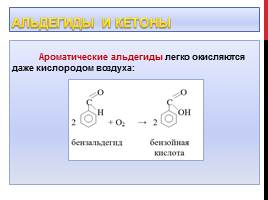
Альдегиды и кетоны
Ароматические альдегиды легко окисляются даже кислородом воздуха:
Слайд 23

Альдегиды и кетоны
Качественные реакции на альдегиды: окисление гидроксидом меди(II) реакция «серебряного зеркала»
Соль, а не кислота!
Слайд 24

Альдегиды и кетоны
Кетоны окисляются с трудом, слабые окислители на них не действуют Под действием сильных окислителей происходит разрыв С - С связей по обе стороны карбонильной группы с образованием смеси кислот (или кетонов) с меньшим числом атомов углерода, чем в исходном соединении:
Слайд 25

Альдегиды и кетоны
В случае несимметричного строения кетона окисление преимущественно осуществляется со стороны менее гидрированного атома углерода при карбонильной группе (правило Попова – Вагнера) По продуктам окисления кетона можно установить его строение:
Слайд 26

Непредельные карбоновые кислоты
Легко окисляются водным раствором KMnO4 в слабощелочной среде с образованием дигидрооксикислот и их солей: В кислой среде происходит разрыв углеродного скелета по месту двойной связи С=С с образованием смеси кислот:
Слайд 27

Щавелевая кислота
Легко окисляется под действием KMnO4 в кислой среде при нагревании до CО2 (метод перманганатометрии): При нагревании подвергается декарбоксилированию (реакция диспропорционирования): В присутствии концентрированной H2SO4 при нагревании щавелевая кислота и ее соли (оксалаты) диспропорционируют:
Похожие презентации
 Проблемное обучение на уроках химии
Проблемное обучение на уроках химии
 Возникновение и развитие химии
Возникновение и развитие химии
 Формирование универсальных учебных действий на уроках химии
Формирование универсальных учебных действий на уроках химии
 Методы познания в химии
Методы познания в химии
 Скорость химических реакций
Скорость химических реакций
Поделиться ссылкой на презентацию через:
Код для вставки видеоплеера презентации на свой сайт:

