Презентация - Первоначальные химические понятия
просмотров
Текст этой презентации
Слайд 1

Подготовила учитель химии
Алимова Э.Н.
МОУ «Вольновская школа»
Республика Крым, П.Вольное
2015 г.
Внеклассное мероприятие по теме «Первоначальные химические понятия»
Слайд 2

обобщить первоначальные химические понятия; уметь составлять химические формулы, проводить расчеты по формулам веществ, проводить опыты по разделению смесей, умения использования химической посуды и оборудования. Уметь работать в коллективе и самостоятельно, выделять главное, сравнивать, делать выводы.
Цели:
Слайд 3

Конкурс №1 «Разминка»
Что изучает наука химия?
Что называется веществом?
Что называется атомом?
Что такое молекула?
Какие вещества называются сложными?
Что называется формулой?
Что обозначает индекс и коэффициент?
Как вычисляют относительную молекулярную массу?
Как рассчитать массовую долю элемента в соединении?
Озвучьте закон сохранения массы веществ.
Слайд 4

Конкурс №2 «Отгадай ребус»
Команда №1
. Mg B Fe K C Pt (молекула) 1 2 3,4 1 1 2,3 Li S H Hg Ca Fe Cu (Лавуазье) 1 4 1 3 2 5 4, 2 Команда №2 As V C Na He (явление) 5 1 3, 4 1, 5 2 Li Sn Cu Os Na Sn S Os W ) по первым буквам.
Слайд 5
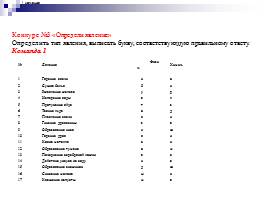
Конкурс №3 «Определи явление»
Определить тип явления, выписать букву, соответствующую правильному ответу.
Команда 1
№ Явления Физич. Химич.
№ Явления Физич. Химич.
1 Горение свечи н о
2 Сушка белья б и
3 Ржавление железа у р
4 Испарение воды а л
5 Протухание яйца т з
6 Таяние льда о д
7 Плавление свечи в и
8 Гниение древесины з а
9 Образование инея н ю
10 Горение дров в и
11 Ковка металла е к
12 Образование тумана о м
13 Почернение серебряной ложки а с
14 Действие уксуса на соду н а
15 Образование снежинок д ю
16 Скисание молока ы к
17 Квашение капусты м а
I команда
Слайд 6

№ Явления Физич. Химич.
№ Явления Физич. Химич.
1 Горение свечи к и
2 Сушка белья з а
3 Ржавление железа у м
4 Испарение воды е с
5 Протухание яйца ы н
6 Таяние льда е ф
7 Плавление свечи н и
8 Гниение древесины б и
9 Образование инея е ц
10 Горение дров ю з
11 Ковка металла а б
12 Образование тумана п о
13 Почернение серебряной ложки с а
14 Образование снежинок х и
15 Изгибание стеклянной трубки а т
16 Действие уксуса на соду ? .
Команда 2
Слайд 7
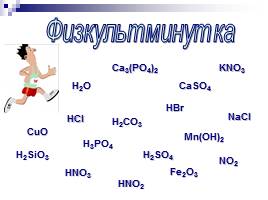
Физкультминутка
H2O
NO2
CuO
CaSO4
H2CO3
H3PO4
H2SO4
Mn(OH)2
HNO3
HNO2
NaCl
HCl
HBr
KNO3
Fe2O3
H2SiO3
Ca3(PO4)2
Слайд 8

Конкурс №4«Признаки химических явлений»
Прочитайте отрывок из книги. Подчеркните упоминание химической реакции. Выпишите признак этой реакции.
« - Я пробью тебя шпагой, как барана! – закричал купец и схватился за свою шпагу. Но шпага так отсырела на морском воздухе, что покрылась ржавчиной и ни за что не хотела вылезать из ножен». Ф.Рабле «Гаргантюа и Пантагрюэль».
«Доктор Окс… попросту разлагал слегка подкисленную воду с помощью изобретенной им батареи… Электрический ток проходил через большие чаны, наполненные водой, которая разлагалась на водород и кислород». Ж.Верн. «Опыт доктора Окса».
Слайд 9

Конкурс №5 «Химик-эрудит»
1-ая команда, «Знаешь ли ты валентность?» Задание №1 а) Составьте формулы сложных веществ образованных элементом кислородом и следующими элементами: Mn(VII); Cr(VI); Si(IV); P(V); Al(III); Mg; Hg(I). б) Обозначьте римскими цифрами валентность элементов в соединениях с хлором, зная, что в данных соединениях он одновалентен: KCl; CaCl2; FeCl3; PCl5; ZnCl2; CrCl3; SiCl4. 2-ая команда, «Знаешь ли ты валентность?».
Задание №1 а) Составьте формулы сложных веществ, образованных элементом кислородом и следующими элементами: Сl(VII); S(VI); As(V); Pb(IV); B(III); Zn; Cu(I). б) Обозначьте римскими цифрами валентность элементов в соединениях с серой, зная, что в данных соединениях она двухвалентна: Al2S3; Na2S; MgS; CS2; Ag2S; ZnS; H2S.
Слайд 10

Конкурс №5 «Химик-эрудит»
Команда 1
Задание №2 “Учись уравнивать.» Расставьте коэффициенты в уравнениях химических реакций, укажите типы химических реакции.
a) P+O2P2O5; б) NaNO3 → NaNO2 + O2 в) Al+CuCl2AlCl3+Cu. г) H2SO4 + KOH = K2SO4 + H2O
Команда 2
a) Fe+Cl2FeCl3; б) Zn+HCl→ZnCl2+H2 в) CH4C+H2. г) CuSO4+NaOH→NaSO4+Cu(OH)2
Слайд 11

Физкультминутка
Правил безопасности много есть друзья
Мы расскажем главные – Ведь без них нельзя!
Опыт можно проводить только с разрешенья
Так как могут не простить
Ваши прегрешенья. (Наклоны головой вперед и назад)
К носу совершай рукой Легкие движенья
Вот тогда нюхач такой
Просто загляденье! (Движения кистями рук поочередно к носу)
Чтоб разбавить кислоту Лил в нее водицу?
Плохо! Видно за версту – Это не годится! (Круговые движения рук в локтевом суставе)
Слайд 12
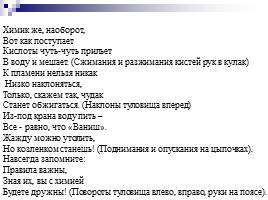
Химик же, наоборот,
Вот как поступает
Кислоты чуть-чуть прильет В воду и мешает. (Сжимания и разжимания кистей рук в кулак)
К пламени нельзя никак Низко наклоняться,
Только, скажем так, чудак
Станет обжигаться. (Наклоны туловища вперед)
Из-под крана воду пить –
Все - равно, что «Ваниш».
Жажду можно утолить,
Но козленком станешь! (Поднимания и опускания на цыпочках).
Навсегда запомните:
Правила важны,
Зная их, вы с химией
Будете дружны! (Повороты туловища влево, вправо, руки на поясе).
Слайд 13

Конкурс №6 «Практический»
Чтобы Золушка не смогла поехать на бал, мачеха придумала ей работу: она смешала древесные стружки с мелкими железными гвоздями, сахар и речным песком и велела Золушке очистить сахар, а гвозди сложить в отдельную коробку. Золушка быстро справилась с заданием и успела поехать на бал. Объясните , как можно быстро справиться с заданием мачехи.
Слайд 14

Конкурс №7 «Решение задач»
1)Вычислите массовые доли элементов Н3РО4, H2CO3
2) Определите простейшую формулу соединения, содержащим по данным анализа, 40% меди, 20% серы и 40% кислорода.
Определите простейшую формулу соединения, содержащим по данным анализа, 24,7% калия, 35% марганца, 41% кислорода.
Слайд 15

Конкурс №8 «Кто он?»
Задание: по описанию важнейших событий жизни и деятельности учёного назвать его имя. За правильный ответ после первой подсказки – 15 баллов, после второй – 10 баллов, после третьей – 5 баллов.
Он – гордость русской науки – воплотил в себе народный гений, широту и силу русского характера. На все века он оставил своей Родине пример того, как наука может и должна служить народу. Подсказка 1. Его исследования известны в области химии, физики, математики, астрономии, это был учёный – энциклопедист. Подсказка 2. Он был первым физико-химиком, создал первую химическую лабораторию и первый университет. «Он, лучше сказать, сам был первым нашим университетом»(А.С.Пушкин) Подсказка 3. Этот учёный сформулировал в своих трудах основные положения атомно – молекулярного учения
Слайд 16

Конкурс «Кто он?»
Это был гениальный учёный, теория и практика всегда неразрывно сочетались в его деятельности. Он был страстным патриотом и смелым защитником прогрессивных идей.
Подсказка 1. Этот учёный был избран почётным членом различных российских учебных заведений и научных обществ, многих иностранных академий наук.
Подсказка 2. Известны его труды по физике, минералогии, метеорологии, экономике. Исследования свойств растворов привели учёного к выводу о химической природе процессов растворения
Подсказка 3. Этот учёный смог объединить разрозненные химические знания в определённую систему и смог найти свойство, объединяющее все химические элементы.
Слайд 17

Рефлексия
Чемодан, мясорубка, корзина
Чемодан – всё, что пригодится в дальнейшем
Мясорубка – информацию переработаю
Корзина – все выброшу
Слайд 18

Спасибо за урок!
Похожие презентации
 Скорость химических реакций
Скорость химических реакций
 Химический состав, строение и функции клеточных мембран - Транспорт веществ через мембрану
Химический состав, строение и функции клеточных мембран - Транспорт веществ через мембрану
 Понятие ДНК. Строение и свойство ДНК
Понятие ДНК. Строение и свойство ДНК
 Алгоритм решения задач по химическим уравнениям
Алгоритм решения задач по химическим уравнениям
 Скорость химической реакции
Скорость химической реакции
Поделиться ссылкой на презентацию через:
Код для вставки видеоплеера презентации на свой сайт:

