Текст этой презентации
Слайд 1

Кислород
Слайд 2

Положение кислорода в п.с.�Электронное строение.
2 период, 2 ряд, 6-А группа
Родоначальник главной подгруппы 6 группы. «Халькогены» - рождающие руды (O,S,Se,Te,Po)
O 8
15,9994 15,9994
[He]2s22p4 [He]2s22p4
Кислород Кислород
Слайд 3

Распространение кислорода в природе.
Кислород – самый распространенный элемент на нашей планете.
Слайд 4
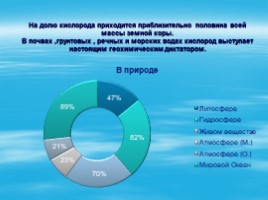
На долю кислорода приходится приблизительно половина всей массы земной коры.�В почвах ,грунтовых , речных и морских водах кислород выступает настоящим геохимическим диктатором.
Слайд 5

Физические свойства кислорода.
Газ без цвета, запаха и вкуса; В жидком состоянии имеет светло-голубую окраску, в твердом – синюю;
В воде газообразный кислород растворим лучше, чем азот и водород.
Слайд 6

Химические свойства кислорода.
Сильный окислитель, взаимодействует, практически, со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре: 4K + O2 → 2K2O
2Sr + O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления: 2NO + O2 → 2NO2
Окисляет большинство органических соединений: CH3CH2OH + 3O2 → 2CO2 + 3H2O
Кислород не окисляет Au и Pt, галогены и инертные газы. С остальными неметаллами взаимодействует, образуя оксиды:
S+O2 →SO2
C+O2 →CO2
Активно взаимодействует со щелочными и щелочно-земельными металлами с образованием оксидов и пероксидов:
2Na+O2→Na2O2
С остальными металлами реагирует при нагревании, выделяя большое количество теплоты и света:
2Mg+O2 →2MgO
Слайд 7

Получение кислорода в лаборатории.
Чаще всего кислород получают нагреванием таких веществ (в состав которых кислород входит в связанном виде), как перманганат калия (марганцовка), хлорат калия (бертолетова соль), нитрат калия (селитра), пероксид водорода:
2 KMnO4 = K2MnO4 + MnO2 + O2
перманганат калия нагревание манганат калия диоксид марганца кислород
2 KClO3 = 2 KCl + 3 O2
хлорат калия нагревание хлорид калия кислород
Слайд 8

2 KNO3 = 2 KNO2 + O2
нитрат калия нагревание нитрит калия кислород
2 H2O2 = 2 H2O + O2
пероксид водорода катализатор кислород
Слайд 9
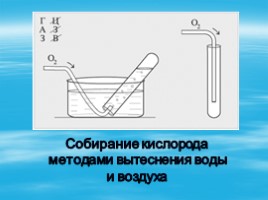
Собирание кислорода
методами вытеснения воды
и воздуха
Слайд 10
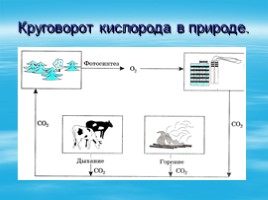
Круговорот кислорода в природе.
Слайд 11

Фотосинтез
Слайд 12

Открытие кислорода.
Кислород был получен им многими способами: прокаливанием оксида ртути (как это сделали Пристли и Лавуазье), нагреванием карбоната ртути и карбоната серебра и т.д. Несомненно, Шееле первым (1772) «держал в руках» чистый кислород.
Слайд 13

Страница рукописи
Шееле
Слайд 14

Джозеф Пристли (Joseph Priestley, 1733-1804)
2 HgO = 2 Hg + O2
оксид ртути нагревание ртуть кислород
Слайд 15

Антуан Лавуазье (Lavoisier, Antoine Laurent, 1743-1794)�
Повторив опыты Пристли, Лавуазье заключил, что атмосферный воздух состоит из смеси «жизненного» (кислород) и «удушливого» (азот) воздуха и объяснил процесс горения соединением веществ с кислородом.� В начале 1775 г. Лавуазье сообщил, что газ, получаемый после нагревания красной окиси ртути, представляет собой «воздух как таковой без изменений (за исключением того, что)... он оказывается более чистым, более пригодным для дыхания».
Слайд 16
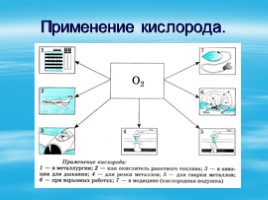
Применение кислорода.
Слайд 17

Спасибо за внимание!
 Витамины
Витамины
 Здоровое поколение XXI века" ("Секреты Колобка") по курсу Химия.Здоровье.Красота.
Здоровое поколение XXI века" ("Секреты Колобка") по курсу Химия.Здоровье.Красота.
 Польза и вред кока - колы
Польза и вред кока - колы
 Вещества и их свойства (8 класс)
Вещества и их свойства (8 класс)
 Качество аспирина и аспирин содержащих веществ.
Качество аспирина и аспирин содержащих веществ.


















